बोर का परमाणु मॉडल
बोर का परमाणु मॉडल यह प्लांक के क्वाण्टम सिद्धान्त (Planck’s quantum theory) पर आधारित है। यह रदरफोर्ड के परमाणु मॉडल में पाये जाने वाले दोषों को दूर करता है और परमाणु के स्थायित्व व उसके रैखिक स्पेक्ट्रम की व्याख्या करता है। नील बोर (Neils Bohr, 1913) ने परमाणु संरचना के सम्बन्ध में निम्नलिखित अभिकल्पनाएँ (assumptions) प्रस्तुत की
- इलेक्ट्रॉन नाभिक के चारों ओर किसी विशेष वृतीय कक्ष (circular orbit) में बिना ऊर्जा का | उत्सर्जन (emission) किये चक्कर लगाते रहते हैं। इन कक्षों को स्थायी कक्षाएँ (stationary orbits) कहते हैं।
-
नाभिक के चारों ओर अनेक वृत्तीय कक्षाएँ सम्भव हैं परन्तु इलेक्ट्रॉन इन सभी सम्भव कक्षाओं में चक्कर नहीं लगाते हैं। इलेक्ट्रॉन केवल उसी कक्षा में चक्कर लगाते हैं जिसमें उसका कोणीय संवेग (angular momentum) 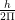 का गुणित (integral multiple) होता है। यदि m द्रव्यमान का इलेक्ट्रॉन, r त्रिज्या वाली कक्षा में v वेग से घूमता है, तो इलेक्ट्रॉन का कोणीय संवेग
का गुणित (integral multiple) होता है। यदि m द्रव्यमान का इलेक्ट्रॉन, r त्रिज्या वाली कक्षा में v वेग से घूमता है, तो इलेक्ट्रॉन का कोणीय संवेग

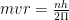
जहाँ, h प्लांक नियतांक है।
n स्थायी कक्षा की क्रम संख्या (principal quantum number) है। n= 1, 2, 3, … या K, L, M, N …
यदि किसी इलेक्ट्रॉन का कोणीय संवेग h/2π हैं, तो वह परमाणु के K-कोश में चक्कर लगाता है। इसी प्रकार यदि किसी इलेक्ट्रॉन का कोणीय संवेग 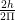 अर्थात्
अर्थात् 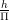 है, तो वह परमाणु के L-कोश (n=2) में चक्कर लगाती है।
है, तो वह परमाणु के L-कोश (n=2) में चक्कर लगाती है।
-
प्रत्येक स्थायी कक्षा की एक निश्चित ऊर्जा होती है। इसलिए इन कक्षाओं को ऊर्जा स्तर (energy level) भी कहते हैं। जैसे-जैसे मुख्य क्वाण्टम संख्या (n) का मान बढ़ता है वैसे-वैसे स्थायी कक्षा की त्रिज्या (r) और उसकी ऊर्जा (E) का मान बढ़ता जाता है। जब तक इलेक्ट्रॉन एक-निश्चित ऊर्जा वाली स्थायी कक्षा में घूमता रहता है, तो वह ऊर्जा का शोषण या उत्सर्जन नहीं कर सकता।

- जब कोई इलेक्ट्रॉन एक स्थायी कक्षा (ऊर्जा स्तर) से दूसरी स्थायी कक्षा (ऊर्जा स्तर) में कूदता है, तो दोनों ऊर्जा स्तरों की ऊर्जा का अन्तर (∆E) एक विकिरण के रूप में अवशोषित (absorb) या उत्सर्जित (emit) होता है। इस विकिरण की आवृत्ति (v) या तरंगदैर्घ्य (λ) का मान निम्नलिखित समीकरण से निकाल सकते हैं।
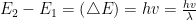
जब इलेक्ट्रॉन एक न्यून ऊर्जा (E1) के स्तर से एक उच्च ऊर्जा (E2) के स्तर में कूदता है, तो परमाणु द्वारा ∆E ऊर्जा अवशोषित होती है। इसके विपरीत, यदि इलेक्ट्रॉन एक-उच्च ऊर्जा (E2) स्तर से एक न्यून ऊर्जा (E1) के स्तर में कूदता है तो ऊर्जा विकिरण के रूप में परमाणु द्वारा उत्सर्जित होती है।
-
इन परिवर्तनों के फलस्वरूप प्राप्त स्पेक्ट्रम में निश्चित आवृति की रेखायें (lines) उत्पन्न होती हैं। इस प्रकार यह मॉडल परमाणु के रैखिक स्पेक्ट्रम की व्याख्या करता है।
परमाणु में इलेक्ट्रॉन हमेशा निम्नतम ऊर्जा वाली कक्षाओं में रहते हैं। इस अवस्था को परमाणु की आद्य अवस्था (ground state) कहते हैं। बाहर से ऊर्जा देने पर इलेक्ट्रॉन उत्तेजित (excite) होकर अधिक ऊर्जा वाली कक्षाओं में कूद जाते हैं। परमाणु की इस अवस्था को उत्तेजित अवस्था (excited state) कहते हैं। परमाणु को बाहर से बहुत अधिक ऊर्जा देने पर इलेक्ट्रान परमाणु को छोड़कर उससे बाहर निकल जाते हैं और धनायन (cation) प्राप्त होते हैं।