वोल्टा ने 1800 ई. के लगभग विभिन्न धातुओं का पुंज (piles) बनाकर पहले पहल विद्युत् धारा प्राप्त की थी। फिर निकलसन और कारलाइल ने वोल्टीय पुंज की विद्युत् धारा द्वारा जल को हाइड्रोजन और ऑक्सीजन में विघटित किया था। इसके बाद 1807 ई. में द्रवित सोडियम के लवण में विद्युत् प्रवाह से सोडियम के लवण में विद्युत् प्रवाह से सोडियम धातु पहले पहल प्राप्त की थी। शीघ्र ही बाद इसी विधि से कैल्सियम, स्ट्रौशियम और वेरियम धातुएँ भी प्राप्त हुई थीं। फिर तो अनेक वैज्ञानिकों ने महत्वपूर्ण योगदान देकर, विद्युत् रसायन को बहुत आगे बढ़ाया। ऐसे वैज्ञानिकों में वर्जीलियस, फैराडे, ओम, हिटॉर्फ, कॉलरॉश, अरेनियस, नर्नस्ट तथा लुईस के नाम विशेष रूप से उल्लेखनीय हैं।
विद्युत रासायनिक श्रेणी
विभिन्न तत्वों को मानक अपचयन इलेक्ट्रोड को बढ़ते हुए क्रम में रखने पर जो श्रेणी प्राप्त होती है। उसे विद्युत रासायनिक श्रेणी (electrochemical series in Hindi) कहते हैं।
Li , K , Ca , Na , Mg , Al , H2 , Zn , Cr , Fe , Ni , Sn , Pb , Cu , I2 , O2 , Fe , Hg , Ag , Cl2 , Mn , F2
- श्रेणी में नीचे से ऊपर की ओर जाने पर ऑक्सीकृत की दर में वृद्धि होती है।
- श्रेणी में ऊपर से नीचे की ओर जाने पर अपचयन क्षमता में कमी होती है।
- श्रेणी में हाइड्रोजन से ऊपर वाले तत्व दुर्बल अपचायक है जबकि हाइड्रोजन नीचे वाले तत्व हाइड्रोजन की तुलना में प्रबल अपचायक है।
- श्रेणी में ऊपर से नीचे की ओर जाने पर इलेक्ट्रॉन को ग्रहण करने की प्रवृत्ति में वृद्धि होती है।
विद्युत रासायनिक श्रेणी के अनुप्रयोग
1. जिस धातु में ऑक्सीकृत की प्रवृत्ति जितनी अधिक होगी। उसकी क्रियाशीलता उतनी ही अधिक होगी। अतः विद्युत रासायनिक श्रेणी में ऊपर से नीचे की ओर जाने पर धातुओं की क्रियाशीलता कम होती है।
2. विद्युत रासायनिक श्रेणी में जिस धातु का स्थान ऊंचा होता है वह धातु अपने से नीचे स्थान की धातुओं को उनके लवण के विलयन से विस्थापित कर देती हैं।
3. विद्युत रासायनिक श्रेणी में धातुओं की धन विद्युती प्रवृत्ति ऊपर से नीचे की ओर घटती जाती है।
4. हाइड्रोजन के नीचे के सभी क्षीण (कमजोर) तत्व धन विद्युती गुण प्रदर्शित करते हैं।
5. विद्युत रासायनिक श्रेणी में ऊपर से नीचे की ओर जाने पर धातुओं की अपचायक क्षमता घटती जाती है।
6. जो धातु श्रेणी में हाइड्रोजन से ऊपर है वह तनु अम्लों के साथ हाइड्रोजन गैस मुक्त कर देती हैं।
7. इस श्रेणी में जो अधातु जितनी नीचे होती है उसकी क्रियाशीलता उतनी ही अधिक होती है।
विद्युत रासायनिक श्रेणी के उपयोग
1. विद्युत रासायनिक श्रेणी की सहायता से धातुओं की क्रियाशीलता ज्ञात की जा सकती है।
2. इस श्रेणी की सहायता से धातुओं की अपचायक क्षमता की तुलना की जा सकती है।
3. इस श्रेणी की सहायता से धातुओं की ऑक्सीकृत प्रवत्ति ज्ञात कर सकते हैं।
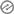 विद्युत रासायनिक श्रेणी के गुण
विद्युत रासायनिक श्रेणी के गुण
- वह धातुएं जो हाइड्रोजन से दुर्बल अपचायक हैं उनका मानक इलेक्ट्रोड विभव धनात्मक होता है।
- वह धातुएं जो हाइड्रोजन से प्रबल अपचायक है उनका मानक इलेक्ट्रोड विभव ऋणात्मक होता है।
- जिन धातुओं की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिक होती है उनका मानक अपचयन विभव धनात्मक होता है।
- श्रेणी में ऊपर से नीचे की ओर जाने पर इलेक्ट्रॉन त्यागने का गुण कम होता जाता है।